LOS ERRORES CONGÉNITOS TIENEN LOS DÍAS CONTADOS PARA SU DIAGNOSTICO: Atención padres!
La Detección Neonatal de Errores Congénitos del Metabolismo (ECM), conocida también como Screening o Pesquisa Neonatal entonces constituye una de las más contundentes herramientas que ha desarrollado la Profilaxis Pediátrica Moderna, fundamentalmente porque estas enfermedades presentan alteraciones bioquímicas que permiten efectuar un diagnóstico certero en los primeros días de vida con un simple análisis de sangre y porque las mismas poseen un tratamiento efectivo ante la implementación precoz del mismo. Así, se puede evitar la instalación del cuadro clínico de la enfermedad, resultando un individuo absolutamente normal.En países desarrollados, el Screening Neonatal forma parte esencial de los Programas de Prevención de la salud. Las estrategias con que se ejecutan los mismos, varían de uno a otro país; sin embargo, en todos los casos se plantea un objetivo común, que es la identificación y prevención de desórdenes de la salud que pueden conducir a problemas potencialmente catastróficos.De ésta manera, hablar de Sreening Neonatal es equivalente a hablar de Medicina Preventiva.
El éxito de un programa de Screening es función de la disponibilidad de métodos bioquímicos adecuados y de la correcta información y concientización de la población en general, y en particular de padres, pediatras, médicos especialistas, bioquímicos, asistentes sociales, nutricionistas, enfermeras y autoridades competentes. Hasta la fecha, se han descripto más de 4000 ECM, de los cuales aproximadamente 70 conducen a un daño cerebral leve o severo, disponiendo 50 de ellos de tratamiento efectivo. Estos últimos resultan clínicamente importantes, si su incidencia también lo es.
**Por qué es un ROL DEL SISTEMA DE SALUD PUBLICA? porque se trata de MEDICINA PREVENTIVA y de ser un DERECHO DE TODOS LOS RECIEN ANCIDOS (ATENCION PRIMARIA)
**A QUE LLAMAMOS ENFERMEDADES POTENCIALMENTE CATASTROFICAS? a las que producen un daño neurológico severo e irreversible, lo que culmina en RETRASO MENTAL. En otros casos tiene lugar un FALLO MULTISISTEMICO y el neonato puede fallecer por una crisis metabólica aguda.
**POR QUE SON DIFICILES DE RECONOCER CLINICAMENTE? porque se trata de enfermedades inaparentes, sin manifestación clínica en los primeros días de vida. Por esta razón, resulta de fundamental importancia en aquellas enfermedades que carecen de síntomas específicos tempranos, que producen daño severo e irreversible y que son pasibles de tratamiento.
¿Cuál es el objetivo de la Pesquisa Neonatal?
- IDENTIFICAR PRECOZMENTE A LOS RECIEN NACIDOS PRESUNTAMENTE AFECTADOS.
- REALIZARLES UN TRATAMIENTO PRECOZ, A EFECTOS DE ELIMINAR O REDUCIR LA MORTALIDAD, MORBILIDAD Y/O DISCAPACIDAD ASOCIADAS CON LA ENFERMEDAD.
¿Qué requisitos debe tener un ECM Error Congénito del Metabolismo) para que sea sometido a un Programa de Screening Neonatal?
Congénito del Metabolismo) para que sea sometido a un Programa de Screening Neonatal?
Según los criterios de WILSON y JUNGNER del año 1968:
- Causar daño severo e irreversible.
- Carecer de signos clínicos y síntomas en el período neonatal.
- Poseer un tratamiento aceptado y efectivo ante la instalación precoz.
- Poseer una incidencia suficientemente alta (usualmente era hasta 1:10000 o 1:40000, pero hoy día se ha relativizado hasta 1: 25000 ) para justificar su investigación.
- Existir un conocimiento acabado del curso clínico de la enfermedad.
- Contar con métodos bioquímicos de diagnóstico presuntivo o screening y confirmación sensibles, específicos, confiables, sencillos y de bajo costo.
- Contar con un sistema adecuado de recolección, transporte y conservación o almacenamiento de las muestras.
- Tener bien definido quiénes deben ser tratados.
¿Cómo debe ser la implementación de un Programa de Pesquisa Neonatal?
- ORGANIZADO COMO PROGRAMA
- GEOGRAFICAMENTE REGIONALIZADO y FUNCIONALMENTE CENTRALIZADO: Los beneficios de la centralización son:
- Aumenta el rendimiento, la eficiencia y la confiabilidad de las pruebas de laboratorio.
- Reduce significativamente los costos (mayor rendimiento de reactivos, menor relación calibradores/controles por muestras corridas.
- Permite el procesamiento diario de las muestras, con una cantidad óptima de entre 200 a 300 por día. En la FUNDACION BIOQUIMICA ARGENTINA, se procesan unas 800 a 850 muestras diarias.
- Contar con equipamiento específico y su eventual automatización.
- Permite validar los métodos.
- Genera la determinación de valores de Corte propios de la población sobre la que se está trabajando.
- Se aplican controles de Calidad INTERNOS y EXTERNOS.
- Se cuenta con un nivel controlado de FALSOS POSITIVOS y FALSOS NEGATIVOS.
- Mayor probabilidad de muestras con resultados anormales en periodos de tiempo cortos.
- Cantidad de casos detectados epidemiológicamente significativos.
- ESTRUCTIURADO DE MANERA TAL QUE CADA UNO DE LOS NIVELES DE EJECUCION (recolección de muestras, transporte, análisis de laboratorio, contactos de localización y seguimiento, confirmación diagnóstica, tratamiento y evaluación sistemática de los resultados) ESTEN PERFECTAMENTE DEFINIDOS Y SE INTEGREN EN FORMA COORDINADA Y DINAMICA.
¿Cuáles son los componentes que hacen a la estructura del Programa de Pesquisa Neonatal?
El Committee on Genetics - American Academy of Pediatrics ha establecido que un Programa de Detección Neonatal de ECM debe incluir los siguientes componentes:
- Educación de padres y médicos.
- Obtención y transporte adecuados de muestras.
- Métodos de screening confiables y de rápida realización.
Ubicación inmediata y seguimiento de los individuos con resultados anormales. - Diagnóstico definitivo con métodos bioquímicos de confirmación.
- Educación, consejo genético y apoyo para las familias de los niños afectados.
- Manejo médico apropiado de los pacientes.
- Evaluación sistemática de los resultados.
De aquí se desprenden una serie de aspectos que deben analizarse en forma particular:
- Equipo multidisciplinario de salud:
* NIVEL GENERAL: Compuesto por los integrantes del equipo de salud que están en el momento del nacimiento (neonatólogos, obstetras, pediatras, técnicos, enfermeros, bioquímicos, asistentes sociales.)
* NIVEL ESPECIALIZADO: el personal que realiza las pruebas, tratamiento y seguimiento del mismo: bioquímicos, médicos endocrinólogos, técnicos, especialistas en enfermedades neurometabólicas, nutricionistas, asistentes sociales, psicólogos.
- Laboratorios:
Los laboratorios de Screening deben funcionar en centros regionalizados de modo tal de asegurar una eficiencia y rendimientos óptimos, con un límite aceptable de resultados falsos positivos, y fundamentalmente, falsos negativos. Estudios estadísticos han demostrado que el rendimiento ideal de un laboratorio se alcanza con 50.000 a 150.000 muestras anuales, con lo cual se asegura también una cantidad de casos detectados epidemiológicamente significativa.
Resulta trascendente la centralización de las muestras en laboratorios regionalizados, a fin de asegurar el procesamiento diario de las mismas y a efectos de contar con métodos de análisis desarrollados específicamente para su utilización en Screening, con equipamiento adecuado y con sistemas de control de calidad interno y externo que permitan un estricto seguimiento de la performance de los métodos. Los laboratorios de confirmación deben contar con tecnología específicamente desarrollada para dicha función, la cual en muchos casos es diferente de la utilizada en la pesquisa. Dichas metodologías deben estar sujetas también a un estricto control de calidad.
- Muestras:
El material biológico de elección puede ser sangre u orina, dependiendo del metabolito que se
desee investigar, siendo las muestras de sangre las más ampliamente usadas.
Tipos de muestras de sangre:
- SANGRE DE CORDON: sus ventajas consisten en su rápida disponibilidad, simpleza del procedimiento y en que no posee restricciones en cuanto al volumen de sangre a extraer. Sus desventajas son por ejemplo que solo permite detectar algunas patologías (Hipotiroidismo, Galactosemia y para determinados analitos)
- SANGRE OBTENIDA DEL RECIEN NACIDO:
- OBTENIDA POR PUNCION DEL TALON:
* POR IMPREGNACION DIRECTA: desde el talón al papel de filtro de la tarjeta colectora.
* POR RECOLECCION CON CAPILARES HEPARINIZADOS Y POSTERIOR IMPREGNACION DEL PAPEL DE FILTRO DE LA TARJETA COLECTORA:La Heparina es el anticoagulante natural del cuerpo y usarlo no genera interferencias, pero sí la generarían anticoagulantes como el EDTA, CITRATO u OXALATO, ya que son complejantes del Calcio e interfieren por ej. en la metodología DELFIA.
- OBTENIDA POR PUNCION VENOSA
- OBTENIDA POR CATETER UMBILICAL: para los casos de recién nacidos en estado crítico.
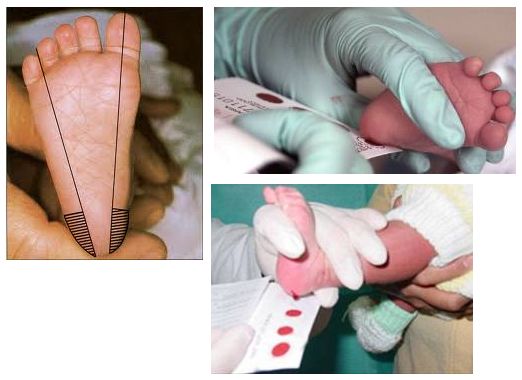
Las muestras de sangre son colectadas mediante un ingenioso sistema propuesto por Robert Guthrie en la década del '60.El mismo consiste en la recolección en tarjetas de papel de filtro Schleicher E. Schuell #903 o Whatman BFC 180, las que se impregnan con sangre tomada preferentemente del talón del bebé, tal como se ve en la foto de la nota.Este tipo de muestra, recolectada en tarjeta de papel de filtro, donde se llena con sangre cada círculo de la tarjeta, uno para cada enfermedad, tiene sus ventajas:
* Se requieren mínimos volúmenes de sangre del bebé.
* Allí los analitos son estables.
* Es simple para transportar.
* Se maneja en forma sencilla en el laboratorio.
* Presenta un riesgo mínimo en la transmisión de infecciones por lo que es mas BIOseguro para el analista.
* Facilidad de almacenamiento.
* Ofrece la posibilidad de realizar estudios retrospectivos.
* No requiere anticoagulante.
Estas muestras, una vez secas, son colocadas en un sobre y remitidas al laboratorio de Screening por vía postal o por el sistema de envíos definido por el programa. Su principal propiedad es la simpleza del transporte y la estabilidad de los analitos a investigar.El National Committee for Clinical Laboratory Standars (NCCLS) en su documento "Blood Collection on Filter Paper for Neonatal Screening Programs" ha establecido las características del papel de filtro, recolección de muestras, condiciones del paciente, envíos y almacenamiento, a fin de disminuir al máximo la variabilidad debida a este procedimiento.En cuanto al momento para la toma de las muestras, la American Academy of Pediatrics estableció que la misma debe realizarse al momento de efectuarse el alta de la maternidad, o como máximo a los 7 días de vida, debiendo considerarse el tipo de alimentación que recibe el paciente, la ingesta de antibióticos ( producen interferencia en técnicas microbiológicas de detección), algún otro tipo de procedimientos como diálisis o transfusiones (pueden hacer medir la actividad de alguna enzima del donante y no del recién nacido), tratamientos maternos (madres hipertiroideas tratadas con antitiroideos), pues estos pueden generar falsos negativos.
Los tiempos de recolección son:
- OPTIMO: 48 hs hasta el 5 to día de vida del bebé.
- OPERATIVO: 24 hs hasta el 7 mo día de vida del bebé.
- EN CASO DE ALTA PRECOZ DE LA MADRE (antes de las 24 hs). Se hace inmediatamente antes del alta y se colecta otra muestra antes de los 7 días.
- GALACTOSEMIA: Para el testeo de esta patología se requiere que haya habido una ingesta de leche materna durante 48 hs previas a la toma de la muestra de sangre del bebé.
¿Por que hay un tiempo mínimo y otro máximo para la toma de la muestra de sangre del bebé?
Porque el tiempo mínimo se debe a que antes de las 24 hs de vida, es sumamente importante la VARIABILIDAD BIOLOGICA, pudiendo haber FALSOS NEGATIVOS en los casos en que deba acumularse el metabolito en el cuerpo, como la PHE (Fenilalanina) para el test de FENILCETONURIA (PKU).También pueden haber FALSOS POSITIVOS, en test de HIPOTIROIDISMO, debido al pico fisiológico de la TSH (Tirotrofina u Hormona estimuladora de la Tiroides) que se produce en todos los bebes por el stress del parto.El tiempo máximo se debe a que el valor diagnóstico del resultado y la efectividad del tratamiento son inversamente proporcionales al tiempo de recolección. por otra partes, el metabolito IRT (TRIPSINA INMUNORREACTIVA) por ej. en el test de FIBROSIS QUISTICA (FQ), cae a valores normales en bebes enfermos luego de los 30 días del nacimiento, por lo que superado ese lapso de tiempo, carece de valor diagnóstico.
- Métodos:
Los métodos de Screening deben ser sensibles, específicos, técnicamente sencillos, de bajo costo y deben permitir procesar una gran cantidad de muestras en forma simultánea para lo cual resulta conveniente que sean automatizables. Los métodos empleados van desde los largamente usados Radioinmunoensayo (RIA), Ensayo Inmunorradiométrico (IRMA), Ensayo de Inhibición Bacteriana de Guthrie (BIA), Fluorometría, Cromatografía Líquida de Alta Performance (HPLC), hasta los métodos isotópicos de desarrollo reciente como el Enzimoensayo (EA), Enzimoinmunoensayo (ELISA), Fluorometría a Tiempo de Resolución (DELFIA) y Quimioluminiscencia.
- Control de Calidad:
Los métodos de Screening deben ser sometidos a exhaustivos controles de calidad internos y externos, existiendo para ello numerosos Programas de Calidad en países como Francia, Inglaterra, Alemania, Italia, Japón, Holanda, Nueva Zelanda y Estados Unidos. Dentro de estos programas es de destacar el Newborn Screening Quality Assurance Program perteneciente al Center for Disease Control and Prevention (CDC) de EE.UU., el cual provee dos veces al año, controles para una evaluación interna (Quality Control), y cuatro al año, controles para una evaluación externa de calidad (Performance Evaluation).
- Comunicaciones:
Se debe contar con un sistema altamente eficiente, fundamentalmente en dos aspectos:
- El traslado seguro y sin demoras de las muestras al laboratorio de Screening.
- La inmediata localización de los pacientes con resultados anormales, ya sea para la toma de una segunda muestra en papel o para derivar al paciente al Centro de Atención Especializada para su confirmación e inicio del tratamiento, lo cual debe ocurrir dentro de los plazos óptimos establecidos.
- Tratamientos:
El tratamiento debe iniciarse lo antes posible y manejarse inicialmente en Centros de Atención Especializadas que cuenten con las herramientas diagnósticas e infraestructura adecuada para confirmar fehacientemente los datos resultantes del Screening.Dicho tratamiento debe ser llevado a cabo por médicos especialistas. De este modo, es posible realizar un seguimiento correcto, obtener datos objetivos que permitan valorar los aspectos favorables y desfavorables del mismo, y también desarrollar formas terapéuticas óptimas. En una segunda fase se puede trasnferir el seguimiento clínico al pediatra de cabecera.
- Industria:
Para la investigación, desarrollo, preparación y comercialización de dietas semisintéticas destinadas al tratamiento de algunas de estas afecciones; para el desarrollo de nuevas alternativas en métodos de análisis de máxima sensibilidad y especificidad, y para el diseño de equipamiento altamente confiable para la automatización de las técnicas de laboratorio.
- Investigación:
Para el mejor conocimiento de los defectos implicados a nivel molecular que permita realizar inferencias respecto de la severidad y pronóstico de la afección, y para el desarrollo de nuevos sistemas de diagnóstico, detección de portadores y tratamiento.
- Aspectos económicos:
La posibilidad de realizar pruebas múltiples con una misma muestra de sangre, disminuye los costos del programa, pues la mayor parte de los mismos no depende en sí del equipamiento empleado, sino de los reactivos, salarios y comunicaciones. Así, cuanta mayor cantidad de ECM investigue un programa, menores serán los costos relativos. Del mismo modo, el hecho de procesar un mínimo de 200 a 300 muestras diarias, permite disminuir el costo por determinación. Los aspectos fundamentales que prevalecen en la implementación de un programa de Detección Neonatal de ECM, son los económicos. Sin embargo, se ha demostrado en países donde estos programas están en vigencia desde hace más de 30 años, que la inversión realizada en la detección precoz de un individuo afectado es mínima, respecto del costo que implica la atención en instituciones especializadas con educación diferencial de un individuo no detectado, y por lo tanto, portador de un retraso mental severo, aún más allá del costo social que implica para su familia.
A pesar de todas las consideraciones analizadas que mejoran la calidad de los resultados,
el pediatra no debe olvidar los aspectos clínicos, aún en aquellos pacientes con un resultado normal en el Screening, puesto que existen variaciones individuales o biológicas y en ocasiones, errores administrativos o de laboratorio que pueden generar falsos negativos. También debe considerarse que las pruebas de Screening no constituyen por sí mismas un diagnóstico y que las mismas forman parte de una estructura que debe funcionar coordinadamente a fin de alcanzar el objetivo real de un Programa de detección de ECM.
¿Cómo son la regulación, legislación y antecedentes de la Pesquisa Neonatal en ARGENTINA?
** A NIVEL NACIONAL:
- Ley 23.413 (octubre de 1986): determina la obligatoriedad de la investigación de Fenilcetonuria.
- Ley 23.874 (octubre de 1990): modificatoria de la anterior, que incorpora a la misma, la investigación de Hipotiroidismo Congénito.
- Ley 24.438 (enero de 1995): modificatoria de las anteriores, que incorpora a las mismas, la Pesquisa de Fibrosis Quística.
** A NIVEL DE LA PROVINCIA DE BUENOS AIRES:
En la provincia de Buenos Aires, se cuenta con la Ley 10.429, la cual declara la obligatoriedad de la investigación masiva de Hipotiroidismo Congénito y Fenilcetonuria en todos los recién nacidos en el ámbito provincial, y también el tratamiento y seguimiento de los pacientes detectados. Dicha ley, promulgada y sancionada en julio de 1986, fue reglamentada en marzo de 1996 por Resolución Ministerial 1343/86.
A partir de esta ley, se constituyó el Programa de Diagnóstico y Tratamiento de Enfermedades Congénitas (PRODYTEC), el cual se lleva a cabo en forma conjunta entre el Ministerio de Salud de la Provincia de Buenos Aires y la Fundación Bioquímica Argentina.
Este programa es coordinado por la Comisión Coordinadora del PRODYTEC, estando presidida por el Director Provincial de Hospitales de este Ministerio e integrada por profesionales médicos y bioquímicos pertenecientes al H.I.A.E.P. "Sor María Ludovica" de Ciudad de La Plata y a la Fundación Bioquímica Argentina. (la cual tiene su laboratorio en el Piso 4 to de la Federación Bioquímica de la Provincia de Buenos Aires, en La Plata).
¿Cuáles son las enfermedades sujetas a Screening Neonatal?
Actualmente la Fundación Bioquímica Argentina tiene implementada la detección neonatal de las 7 patologías más importantes, las cuales constituyen las ENFERMEDADES DEL PANEL CLASICO, que son, (de mayor a menor frecuencia):
|
FIBROSIS QUISTICA |
1:2.500 |
|
HIPOTIROIDISMO CONGENITO (HC) |
1:3.000 |
|
FENILCETONURIA (PKU) |
1:10.000 |
|
HIPERPLASIA SUPRARRENAL CONGENITA (HSC) |
1:12.000 |
|
GALACTOSEMIA |
1:60.000 |
|
DEFICIENCIA DE BIOTINIDASA |
1:70.000 |
|
ENFERMEDAD DE LA ORINA DEL JARABE DE ARCE (LEUCINOSIS) |
1:250.000 |
Otras importantes ECM son las siguientes aunque no forman parte del PANEL CLASICO sino del llamado PANEL AMPLIADO (VER el otro artículo):
|
HEMOGLOBINOPATIAS Y TALASEMIAS |
1:1.500 |
|
DISTROFIA MUSCULAR DUCHENNE |
1:4.000 |
|
DEFICIT DE ACIL CoA DESHIDROGENSASA DE CADENA MEDIA |
1:7.500 |
|
HISTIDINEMIA |
1: 12.500 |
|
CISTINURIA |
1:15.000 |
|
CIOSTINOSIS |
1:60.000 |
|
HOMOCISTINURIA |
1:100.000 |
La Fundación Bioquímica Argentina (FBA) implementó en enero de 1991 un Programa de Detección Neonatal de PKU (Fenilcetonuria), al cual se le incorporó en julio de 1992 la pesquisa de HCP (Hipotiroidismo Congénito Primario), en julio de 1995 la de FQ (Fibrosis Quística) y Galactosemia, en diciembre de 1997 la de HSC (Hiperplasia Suprarrenal Congénita) y Deficiencia de Biotinidasa y en noviembre de 2001 la de Enfermedad de Orina de Jarabe de Arce.En febrero de 1995, la FBA firmó un Convenio con el Ministerio de Salud de la Provincia de Buenos Aires, por el cual se comprometió a la investigación de Fenilcetonuria e Hipotiroidismo Congénito en todos los recién nacidos en maternidades de Hospitales Provinciales. De tal forma, el Laboratorio de Detección de Errores Congénitos de la FBA es también el Laboratorio de Pesquisa del Programa de Diagnóstico y Tratamiento de Enfermedades Congénitas (PRODyTEC), ejecutado por dicho Ministerio de Salud.
Características de las patologías investigadas en el Panel Clásico recién visto:
1) Fibrosis Quística (FQ):
La FQ es una enfermedad congénita que se transmite con un patrón de herencia autosómico recesivo. La misma se caracteriza por enfermedad pulmonar crónica, insuficiencia pancreática exócrina e incremento de electrolitos en el sudor, y se manifiesta con una frecuencia aproximada de 1:2500 nacidos vivos. El defecto se halla localizado en una proteína transportadora de membrana (CFTR) relacionada con el trasnporte de iones cloruro en las células epiteliales.La producción de un moco viscoso y grueso en el tracto respiratorio es causante de la obstrucción de las vías aéreas facilitando así la infección bacteriana, principalmente por Pseudomona y Stapylococcus. La enfermedad pancreática es reponsable del retraso de crecimiento, esteatorrea y deficiencia nutricional, causando también íleo meconial en 20% de los neonatos. El diagnósticode FQ en el período neonatal permite reducir la extensión y severidad de la morbilidad y la tasa de mortalidad temprana.En el screening se dosa tripsina inmunorreactiva (IRT) en sangre, la cual se encuentra aumentada en los pacientes afectados debido al bloqueo de los ductos pancreáticos por efecto de las secreciones características de esta enfermedad.En individuos fibroquísticos la IRT disminuye en forma progresiva a valores normales a partir de aproximadamente los 30 días de vida, debido a que el tejido pancreático normal es reemplazado paulatinamente por tejido fibroso y graso (21). Dado que no todas las mutaciones en el gen del CFTR resultan en niveles elevados de IRT, los Programas de screening Neonatal deben informar claramente que hasta el presente no es posible detectar el 100% de los casos analizados.
2) Hipotiroidismo Congénito Primario (HCP):
El HCP es un desorden de la función tiroidea caracterizado por una producción reducida de hormonas tiroideas, que consecuentemente genera niveles circulantes deficientes de las mismas. Dicha deficiencia en el período neonatal, es responsable de un importante retraso en el crecimiento y en el desarrollo mental.Esta enfermedad manifiesta algunos síntomas y signos inespecíficos que pueden orientar al diagnóstico clínico precoz, como ictericia prolongada, caída tardía del cordón, fontanela posterior mayor de 1 cm, retraso en la eliminación del meconio, hernia umbilical, constipación, macroglosia, abdomen distendido, cabello grueso, piel fría, hipotermia, edad ósea retrasada y dificultad en la alimentación. Sin embargo, debe recalcarse que sólo el 5% de los casos de HCP son diagnosticados sobre la base de manifestaciones clínicas, las cuales en general son moderadas y de progresión lenta. El HCP puede reconocer distintos orígenes:
Causas de HCP:
- DISGENESIA TIROIDEA (85-90%): Agenesia, Ectopía ó Hipoplasia
- DISHORMONOGENESIS (5-10%):
Defecto en el receptor de TSH-Defecto post-receptor de TSH-Defecto en el transporte de iodo-Defecto en el sistema de peroxidación-Defecto en tiroglobulina-Defecto en iodotirosina desiodinasa.
Existe un 3-4% restante que corresponde a hipotiroidismo secundario o terciario, donde la afectación se localiza a nivel de hipófisis o hipotálamo. La frecuencia con que se manifiesta el HCP es de 1:3000 recién nacidos. El tratamiento requiere la administración de sustitutos de hormona tiroidea (levotiroxina) antes de los 21 días de vida, con lo cual se evita, fundamentalmente, el daño neurológico. Para la detección neonatal puede investigarse TSH (tirotrofina) y T4. En algunos programas se mide solamente TSH o T4, en cambio en otros se determinan ambos parámetros.
El diagnóstico definitivo se realiza midiendo el TSH, T3, T4 y T4 libre en suero del paciente, evaluando la edad ósea radiológicamente y determinando las características de la tiroides por centellografía.
3) Fenilcetonuria (PKU):
La Fenilcetonuria (PKU) es una ECM de Fenilanina (Phe) capaz
de causar retraso mental irreversible en ausencia de tratamiento, debido, en el 97-99%
de los casos, a deficiencia en la enzima Phe-hidroxilasa hepática.
La enfermedad cursa con niveles de Phe aumentados en sangre, lo cual permite establecer
su diagnóstico en el período neonatal, cuando aún las manifestaciones clínicas no son evidentes.
La frecuencia con que se presenta es de 1:10000 nacidos vivos, y su patrón de herencia es autonómico recesivo.
El tratamiento consiste en la administración de una dieta especial restringida en Phe, bajo control continuo y cuidadoso. Dicho tratamiento debe iniciarse antes del mes de vida, a fin de conseguir un desarrollo intelectual normal del niño. Existe una forma menos frecuente de PKU (1-3%), debida a deficiencia de tetrahidrobiopterina (THB), que es un cofactor natural de la Phe-hidroxilasa, donde el defecto puede hallarse en la vía de síntesis o de reciclado del mencionado cofactor.
En estos casos, el tratamiento debe efectuarse suplementando además con el cofactor activo,
L-DOPA y 5-OH triptofano.
También existen deficiencias menos severas de la enzima Phe-hidroxilasa, las cuales cursan con niveles moderadamente aumentados de Phe en sangre y reciben el nombre de Hiperfenilalaninimias (HPA). en las mismas, la necesidad de implementación del tratamiento depende de la tolerancia
a la sobrecarga oral de Phe y de los niveles alcanzados por el aminoácidos en sangre.
4) Hiperplasia Suprarrenal Congénita (HSC):
La HSC es un desorden heredado en forma autosómica recesiva cuya frecuencia establecida internacionalmente es de aproximadamente 1 : 12.000 nacidos vivos. La misma, es ocasionada por un defecto en alguna de las 5 enzimas que intervienen en la esteroidogénesis adrenal, lo cual trae aparejado una caída en la producción de cortisol y, en algunos casos, una disminución en la producción de aldosterona.
En más del 95 % de los casos la enzima afectada es la 21-Hidroxilasa, siendo la 17-alfa-Hidroxi progesterona (17-OHPG) el principal precursor que se acumula en sangre. Por esta razón, es el parámetro bioquímico de elección para la detección de HSC en Programas de Pesquisa Neonatal.
Desde el punto de vista clínico - bioquímico, el déficit de 21-Hidroxilasa posee distintas formas
de presentación:
1) Forma perdedora de sal: se presenta con un déficit tanto de glucocorticoides como de mineralocorticoides, observándose una excesiva producción de andrógenos.
2) Forma virilizante simple: no se manifiestan pérdidas de sodio en orina ni hipercaliemia, sugiriendo que los pacientes afectados controlan la producción de mineralocorticoides.
3) Forma no clásica o tardía:
su principal signo clínico es la aparición de hirsutismo en la adolescencia.
4) Forma asintomática o críptica: carece de manifestaciones clínicas.
Los pacientes del primer grupo pueden parecer normales al nacimiento, pero entre los 7 y 30 días de vida desarrollan una crisis salina que puede llevarlos a la muerte si no son diagnosticados y tratados adecuadamente. El exceso de andrógenos que se produce en los pacientes de las 3 primeras formas determina que las niñas afectadas presenten al nacimiento genitales ambiguos, con distintos grados de virilización. Si este exceso de andrógenos no es corregido, traerá aparejado en ambos sexos un aceleramiento del crecimiento óseo con cierre temprano de las epífisis y desarrollo de pubertad precoz.
El tratamiento se basa en la administración de sustitutos hormonales que cumplen la función de las hormonas faltantes. En el caso de los pacientes que presentan la forma perdedora de sal se busca corregir el déficit tanto de mineralocorticoides como de glucocorticoides, en tanto en los grupos restantes solo es necesaria la corrección de estos últimos.
El objetivo principal del tratamiento consiste en lograr que el organismo sea capaz de mantener un balance adecuado de sales y agua, alcanzando parámetros normales de crecimiento, maduración sexual y fertilidad en la vida adulta. El control del progreso del tratamiento se realiza mediante evaluaciones clínicas y monitoreos periódicos que permiten ajustar las dosis de la medicación.
5) Galactosemia:
Se conocen tres tipos de errores congénitos del metabolismo (ECM) de galactosa (GAL) originados en la deficiencia de distintas enzimas involucradas en la ruta metabólica principal, los cuales difieren en su cuadro clínicos y en su patrón bioquímico en sangre. De acuerdo a la severidad de dicho cuadro, la más importante es la deficiencia de Gal-1-P-Uridil Transferasa, la cual se conoce comúnmente como Galactosemia Clásica. La misma es capaz de producir retraso mental, cataratas, toxicidad hepatorrenal y en ocasiones la muerte del individuo a los pocos días de vida. La afección cursa con niveles elevados de GAL Total lo cual permite su detección en sangre del recién nacido. El patrón de herencia es autosómico recesivo y la frecuencia con que se manifiesta es de 1:60000. La restricción dietaria de GAL en el período neonatal evita la instalación de los mencionados síntomas y los pacientes resultan normales.
6) Deficiencia de Biotinidasa:
Se trata de un error congénito del metabolismo que carece de signos clínicos en el período neonatal, capaz de producir síntomas neurológicos como convulsiones, pérdida de la audición y la vista, ataxia, hipotonía y otras manifestaciones como retraso del crecimiento, hiperventilación, apneas, dermatitis y alopecía. En ausencia de tratamiento, el inicio de la enfermedad se da en promedio a los tres meses de vida, pudiendo retrasarse hasta los 2 años.
Desde el punto de vista bioquímico presenta una deficiencia en la enzima Biotinidasa, la cual tiene como función la recuperación de biotina, vitamina soluble del complejo B, de la vía de degradación de las carboxilasas Piruvato CoA-, Propionil CoA-, b-Metilcrotonil CoA- y Acetil CoA-.
A consecuencia de esto, los pacientes pueden presentar aciduria orgánica, cetoacidosis
metabólica e hiperamonemia moderada.
El diagnóstico neonatal se efectúa midiendo la actividad de Biotinidasa en sangre entera colectada en papel de filtro, pudiendo detectarse deficiencias absolutas o parciales de la misma, según si su actividad es < 10 % o de un 15-30 % respectivamente.
El patrón de herencia es autosómico recesivo y la incidencia estimada es de 1:45.000.
El tratamiento se realiza administrando por vía oral dosis farmacológicas de biotina de 5 a 20 mg/día, con lo cual es posible evitar la instalación de los síntomas.
7) Enfermedad de Orina de Jarabe De Arce:
La Enfermedad de Orina de Jarabe de Arce, conocida también como MSUD (Maple Syrup Urine Disease) o Leucinosis, es un error congénito del metabolismo de los aminoácidos de cadena ramificada producida por una deficiencia en la decarboxilación oxidativa de los cetoácidos correspondientes a estos 3 aminoácidos. El patrón de herencia con que se transmite es autosómico recesivo, en tanto su incidencia es variable encontrándose datos en la bibliografía que oscilan entre 1:185.000 nacidos vivos en individuos anglosajones y 1:60.000 nacidos vivos en individuos latinos. La orina de estos bebes, huele dulce y a jarabe de arce.
La enfermedad posee 5 formas fenotípicas de presentación que se describen a continuación:
- Forma Clásica: es la de mayor interés por la severidad de su cuadro clínico y por ser la más común de todas. La misma se caracteriza por un cuadro de encefalopatía de comienzo neonatal, con rechazo de la alimentación y somnolencia alrededor de los 10 días de vida que progresa rápidamente al coma sin causa aparente. Posteriormente, se instala un cuadro neurológico de severidad progresiva que conduce al paciente a la muerte cuando no se realiza un diagnóstico precoz e inicio inmediato del tratamiento adecuado. Como dato particular, y simultáneamente con el cuadro antes descripto, el bebé presenta un olor característico en piel y orina que se asemeja a azúcar quemada o jarabe de arce. Desde el punto de vista bioquímico se caracteriza por un defecto en la enzima Deshidrogenasa de los cetoácidos de cadena ramificada (actividad 0-2 %), el incremento de Val, Leu e Ile en sangre y orina, la presencia de Alo-Ile, y la excresión urinaria de los correspondientes cetoácidos.
- Forma Intermitente: su forma de presentación es más leve, y las crisis metabólicas recurrentes se desencadenan por infecciones o después de una ingesta importante de proteínas. Los individuos afectados por esta forma pueden ser sanos durante su primera infancia e incluso hasta antes de la adolescencia. Durante los períodos de crisis se encuentran niveles aumentados de Val, Leu e Ile, mientras que en los períodos intercríticos el cuadro clínico-bioquímico es absolutamente normal. A pesar de esto, y de acuerdo con el grado de severidad observado durante las crisis se pueden presentar secuelas neurológicas importantes.
- Forma Intermedia: se caracteriza por un cuadro clínico menos severo que la forma Clásica. Los individuos afectados presentan retraso de crecimiento y retardo mental en ausencia de tratamiento. Bioquímicamente se caracteriza por presentar una actividad enzimática residual de 3 a 30 % con una elevación persistente de Val, Leu e Ile.
- Forma Respondedora a Tiamina: se presenta en pacientes con un cuadro clínico similar a la forma intermedia, pero a diferencia de aquella requiere para su tratamiento además de la restricción dietaria de Val, Leu e Ile, la administración de dosis variables de tiamina.
- Forma Deficiente en Subunidad E3: es una forma muy poco frecuente que afecta a una de las 3 subunidades de la enzima Deshidrogenasa de los cetoácidos de cadena ramificada. Se caracteriza por presentar un cuadro similar al de la forma intermedia pero acompañado de acidosis láctica.
Con respecto al tratamiento la única alternativa posible de es mediante la restricción dietaria de proteínas y más específicamente de los aminoácidos de cadena ramificada, siendo su efectividad dependiente de la precocidad con que se implemente el mismo. Las normas recomiendan iniciarlo antes de los 10 días de vida para asegurar la ausencia de secuelas neurológicas.
Conclusiones:
La detección Neonatal de los Errores Congénitos es una de las principales herramientas con que cuenta la Medicina Preventiva.
El objeto final consiste en que un individuo potencialmente discapacitado mental o con riesgo de vida, pueda desarrollarse con su capacidad física e intelectual intacta, eliminando así el costo social que implica un diagnóstico tardío, para su familia y permitiendo su inserción productiva en la sociedad.
Considerando que el número de nacimientos en la Provincia de Buenos Aires está en el orden de los 250.000 por año, que la ley 10.429 de dicha Provincia establece la obligatoriedad de la investigación en todos los recién nacidos de la PKU y el HCP y extrapolando las frecuencias obtenidas para estas dos patologías en nuestro medio, por año debieran detectarse en promedio 15 casos de PKU, 16 de HPA y 107 de HCP. De este modo anualmente más de 120 niños quedarían protegidos de las severas secuelas neurológicas que se manifiestan en ausencia de diagnóstico y tratamiento precoz.
Efectuando una evaluación similar para la FQ y la Galactosemia, las cuales no están comprendidas en el marco de la ley 10.429, debieran detectarse 83 casos de FQ y 6 de Galactosemia clásica por año. Finalmente, queda planteada la necesidad de lograr a través de los medios de comunicación social la correcta educación y toma de conciencia de la población en general, y en particular del Equipo de Salud, a los fines de alcanzar una cobertura del 100 % sobre la población neonatal y de obtener la máxima efectividad en la prevención de estas patologías.
Hoy día en Argentina, se sigue proponiendo ampliar la detección de Errores Congénitos en el recién nacido:
La primera ley de pesquisa neonatal en Argentina fue la N° 23413/86. En la actualidad la Ley Nacional 26.279 del año 2007, obliga a los hospitales públicos y privados a extraerles una muestra de sangre a los bebés al momento de nacer para detectar nueve patologías entre las que se encuentran la Fenilcetonuria, el Hipotiroidismo, la Fibrosis Quística, la Galactosemia, la Hiperplasia suprarrenal congénita, la Deficiencia de Biotinidasa, la Retinopatía del prematuro, el Mal de Chagas y la Sífilis.
Hace dos años se promulgó la Ley 26.689, aún no reglamentada, que obliga a ampliar la pesquisa neonatal a más de 25 enfermedades poco frecuentes, utilizando las mismas 5 gotas de sangre que las que se usan para el diagnóstico actual. Esta nueva normativa con la capacidad de detectar más del doble de ECM, apunta más al cuidado integral del paciente, y está más orientada a la cobertura del tratamiento que a la implementación de la pesquisa.
Cada vez más países incorporan el diagnóstico extendido. Uruguay, por ejemplo, desde el año 2008 está trabajando en la incorporación paulatina de patologías a la pesquisa. EEUU es el país más avanzando con más de 22 afecciones por screening y, según datos recientes surgidos de un encuentro de expertos que se realizó en California (Newborn Screening), por cada dólar que se invierte en la PNA, se ahorran 9 dólares en futuros costos médicos.
Tanto en la Ciudad de Buenos Aires como en la Provincia de Buenos Aires, ya se han instalado los equipos que permiten realizar el screening para el PANEL AMPLIADO (Espectrómetro de Masas en Tandem) y es cuestión de tiempo para que se reglamente la Ley 26.689 y se implemente la pesquisa ampliada en ambos territorios.
Evidencias médicas:
En el año 2003 se publicó en la revista JAMA un estudio que realiza una comparación entre el diagnóstico temprano versus el tardío, que evaluó a 50 niños a los que se les había realizado el screening y a 33 que no se los evaluó de esta manera sino a través de una identificación clínica. Los resultados obtenidos fueron estadísticamente significativos a favor del diagnóstico temprano o screening. De los 50 niños que habían sido pesquisados, el 28% debió ser hospitalizado por los menos 1 vez durante los primeros 6 meses de vida mientras que de los que fueron diagnósticados tardíamente, el 55% fue hospitalizado.
De los pesquisados a tiempo, el 4% ingresó a la Unidad de Terapia Intensiva (UTI) mientras que del grupo de los no evaluados por screening, tuvo una internación del 21%. En cuanto al comienzo del tratamiento, el primer grupo comenzó a las 2 semanas del nacimiento mientas que el otro lo hizo a los 4 meses. Respecto a las complicaciones neurológicas, representa al 14% de los pesquisados, mientras en la población de niños no diagnosticados se dio en el 54%.
“Cuanto más temprano se realice el diagnóstico en el recién nacido, más beneficioso será para instaurar un tratamiento y así poder cambiar el curso de la enfermedad. Patologías que muchas veces no diagnosticas o mal diagnosticadas pueden ser discapacitantes. Por eso la importancia de una pesquisa neonatal cada vez más ampliada” concluyó la doctora Schenone.
L. Laura Ocera.